7.3 fotoquímica de
la visión
Ciclo Visual Rodopsina-Retina y Excitación de los Bastones
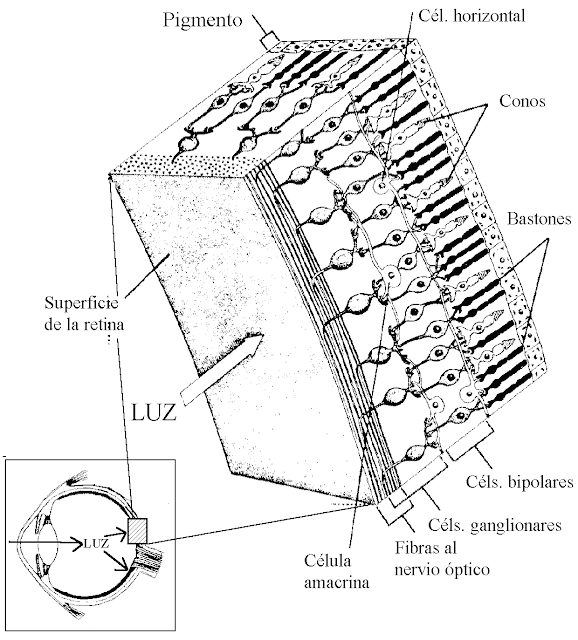
El segmento externo del bastón que se extiende hasta la capa
pigmentaria de la retina, tiene 40% de concentración de la rodopsina o púrpura
visual. Esta sustancia se compone de una combinación de la proteína escotopsina
y del pigmento carotenoide retinal.
Además esta forma de retinal, es de un tipo determinado,
denominado 11-cis retinal. Esta forma cis del retinal es importante porque se
trata de la única que o puede unirse a la escotopsina para sintetizar la
rodopsina.
Cuando la rodopsina absorbe la energía lumínica, este pigmento
se descompone en billonésimas de segundo. La causa reside en la fotoactivación
de los electrones de la fracción retinal de la rodopsina, que determina un
cambio instantáneo de la forma cis a la forma toda-trans que conserva la misma
estructura química que la forma cis, pero con una
estructura física distinta: se trata de una molécula
recta en lugar de una molécula doblada. Como la orientación tridimensional del
los sitios de reacción de todo-trans retinal ya no se ajusta a los sitios de
reacción de la proteína escotopsina, aquél comienza a separarse de la
escotopsina. El producto inmediato
es la batorrodopsina, una combinación parcialmente disociada del todo-trans
retinal y la escotopsina.
La batorrodopsina es sumamente inestable y se descompone en
nanosegundo en lumirrodopsina. Ésta, a su vez, se decompone en microsegundo en
metarrodopsina I; a continuación, en un milisegundo aproximadamente forma
metarrodopsina II y, por último, mucho más lentamente (en segundos), se descomponen
los productos completamente
disociados:
*Escotopsina.
Todo-trans retinal.
La metarrodopsina II, también llamada rodopsina activa, es la
que introduce los cambios eléctricos de los bastones que transmite después la
imagen visual al sistema nervioso central.
*Regeneración de la Rodopsina
La primera etapa de la regeneración de la rodopsina consiste en
la reconversión del todo-trans retinal en 11-cis retinal.
Este proceso requiere energía metabólica y está catalizada por
la enzima retinal isomerasa. Una vez formado el 11-cis retinal, se recombina
automáticamente con la escotopsina para volver a formar rodopsina, la cual
permanece estable hasta que la absorción de energía lumínica vuelve a
desencadenar su descomposición.
*Función de la Vitamina A en la Formación de Ropsina
Existe una segunda vía química mediante la cual el todo-trans
retinal se convierte en 11-cis retinal. Consiste en la conversión de todo-trans
retinal primero en todo-trans retinol que es una forma de la vitamina A.
Después, de todo- trans retinol se transforma en 11-cis retinol por la
influencia de la enzima isomerasa; y, por último, el 11-cis retinol se
convierte en 11- cis retinal que se combina con la escotopsina para formar
nueva rodopsina. La vitamina A está presente tanto en el citoplasma de las
bastones como en el epitelio pigmentario de la retina; en consecuencia, en
condiciones normales siempre se encuentra disponible para formar nuevo retinal
cuando se necesita por el contrario, cuando la cantidad de retinalen la retina
resulta excesiva, el sobrante se convierte de nuevo en vitamina A, con lo que
disminuye la cantidad de pigmento fotosensible de la retina.
Esta interconversión entre el retinal y la vitamina A contribuye
de modo especial a la adaptación a largo plazo de la retina a las
diferentes
intensidades de luz.
*Fototransducción
Cuando la retina esta en condiciones de oscuridad, se encuentran
abiertos una serie de canales iónicos a nivel de los segmentos externos de los
fotorreceptores que permiten la entrada fundamentalmente de iones Sodio. Esta
entrada de Sodio, despolariza parcialmente a los fotorreceptores, permitiendo
la liberación de neurotransmisor a nivel de sus terminales sinápticos.
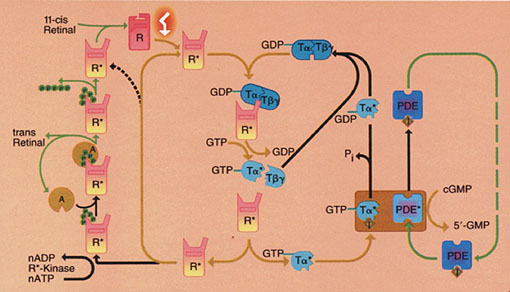
El transmisor liberado se supone que es Glutamato. Cuando la luz
estimula a la molécula de rodopsina, se producen una sería de cambios que se
presentan esquemáticamente en la imagen siguiente, que van a producir el cierre
de los canales iónicos permeables al sodio.
Por tanto cesa la entrada de sodio y el fotorreceptor se
hiperpolariza, con lo que deja de liberar el neurotransmisor.
La corriente que se produce durante las condiciones de oscuridad
es debida en un 80% a la entrada de iones sodio, sin embargo el canal es
también permeable a los iones calcio y magnesio. Además en oscuridad debe
existir un mecanismo para eliminar tanto el calcio como el exceso de sodio.
Este mecanismo parece ser que consiste en un intercambiador sodio/calcio a
nivel de la membrana de los segmentos externo. El calcio, además tiene un
importante papel en todo el proceso de la fototransducción, ya que aunque no
participa directamente en la cascada de la fototransducción, mejora la
capacidad de los bastones para recuperarse después de la iluminación, teniendo
un importante papel regulador en los fenómenos de adaptación a las condiciones
de luz/oscuridad.
*Fotoquímica de la Visión en Color por los Conos
La composición química de los fotopigmentos de los conos
coincide casi por completo con la de la rodopsina de los bastones. La única
diferencia reside en que las porciones proteicas, las opsinas, llamados
fotopsinas en los conos, son ligeramente distintas de la ecotopsina de los
bastones. La porción retinal de todos lo pigmentos visuales es exactamente la
misma en los conos que en los bastones. Los pigmentos sensibles al color de los
conos son, por tanto, combinaciones de retinal y fotopsinas.
Cada uno de los diferentes conos sólo posee uno de los tres
tipos de pigmentos de color lo que determina la sensibilidad selectiva de los
conos a colores
distintos: azul, verde y rojo. Estos pigmentos de color se denominan
respectivamente, pigmento sensible al azul, pigmento sensible al verde y
pigmento sensible al rojo.
Referencias:



No hay comentarios:
Publicar un comentario